| Rev Esp Endocrinol Pediatr 2018;9(2):38-49 | Doi. 10.3266/RevEspEndocrinolPediatr.pre2018.Jun.478 | |||||||||
| Hipotiroidismo subclínico en la niñez y la adolescencia | |||||||||
| Subclinical hypothyroidism in childhood and adolescence | |||||||||
| Sent for review: 1 May. 2018 | Accepted: 28 Jun. 2018 | Published: 20 Dec. 2018 | |||||||||
| Roberto Bogarín Solano1, Fred Cavallo Aita1, Oscar Arce Castillo2, Juan Diego Salazar Borbón3 | |||||||||
| 1 Endocrinologia Pediátrica. Hospital Nacional de Niños. San José (Costa Rica) 2Medicina General. San José (Costa Rica) 3Medicina General. Hospital Clínica Bíblica. San José (Costa Rica) | |||||||||
| Correspondence:Juan Diego Salazar Borbón, Medicina General, Hospital Clínica Bíblica, San Francisco de Heredia, 40103, San José, Costa Rica E-mail: jdiegosalazar@gmail.com E-mail: oscaraa.147@gmail.com | |||||||||
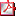 Tabla 1 - Causas de hipotiroidismo subclínico en pediatría Tabla 1 - Causas de hipotiroidismo subclínico en pediatría | |||||||||
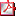 Tabla 2 - Resumen de los principales estudios que han descrito la historia natural del HS en niños Tabla 2 - Resumen de los principales estudios que han descrito la historia natural del HS en niños | |||||||||
| |||||||||
Introducción: El hipotiroidismo subclínico (HS) es una condición bioquímica caracterizada por la elevación sérica de los niveles de hormona estimulante del tiroides (TSH) por encima del límite superior de referencia, acompañado de una concentración normal de hormonas tiroideas, y sin manifestaciones clínicas de hipotiroidismo (1). Los reportes en cuanto a la prevalencia del HS en la población general varían considerablemente. Una de las razones son los distintos límites superiores establecidos en cada laboratorio (2).
El estudio de la función tiroidea es cada vez más frecuente debido a la presencia de historia familiar de enfermedad tiroidea, bocio, o como parte de análisis de control, lo cual ha hecho que la prevalencia de HS en niños y adolescentes sea cada vez mayor (3). En la población adulta, la prevalencia de HS es de 1-10%, y la incidencia es de aproximadamente 3-15% (4). En cambio, determinar la incidencia y la prevalencia en la población pediátrica tiene como limitación la poca cantidad de estudios al respecto. Algunos autores han determinado que la prevalencia es menor a un 2% (1,5); en cambio, otros establecen un rango entre 1,7%-9,5% (3). Algunos factores conocidos que aumentan la incidencia son la edad, el sexo femenino y estado subóptimo de yodo (1).
Gran parte de los estudios que analizan esta patología se han realizado con muestras pequeñas, con poblaciones heterogéneas, y ocasionalmente muy específicas, por lo cual aun hay vacíos en la evidencia.
Causas:
El HS puede tener un origen autoinmune o no autoinmune, congénito o adquirido, transitorio o permanente (6) (Tabla 1).
El HS en niños es causado en un 50-80% de los casos por tiroiditis autoinmune crónica, la cual se caracteriza por altos títulos de anticuerpos anti-tiroperoxidasa (anti-TPO), anti tiroglobulina (anti-Tg) y en pocas ocasiones anticuerpos contra el receptor de TSH (anti-rTSH). Sin embargo, también existen otra gran cantidad de causas reversibles e irreversibles. Existen asociaciones y causas de índole no tiroidea como diabetes mellitus tipo 1 (DM1), fibrosis quística (FQ), enfermedad celiaca y enfermedad renal crónica (1).
Entre las causas genéticas, se han encontrado mutaciones en varias proteínas necesarias para la acción de la TSH. Algunas mutaciones en la función enzimática de la oxidasa dual (Dual Oxidase 2 DUOX2), la fosfodiesterasa 8B y la peroxidasa tiroidea, se han relacionado con aumentos moderados de TSH. Además, ciertas condiciones congénitas se relacionan con el HS; por ejemplo, el HS se encuentra en un 32% de los pacientes con trisomía 21 (1). Un estudio sugiere que virtualmente todos los individuos con trisomía 21 poseen una alteración en la regulación de la glándula tiroidea, que puede estar relacionada a la trisomía (7).
En cuanto a alteraciones en el receptor de TSH (rTSH) que pueden llevar a HS, se han identificado mutaciones en el exón 4 del gen de THSR que codifica el dominio extracelular del rTSH (8). También se ha demostrado que alteraciones en la vía de transducción del receptor de TSH pueden ser responsables de HS (9). En un estudio se evaluaron las variaciones en el gen del rTSH en una serie de niños con HS de causa no autoinmune; se encontró en 21,5% de los casos mutaciones no sinónimas o polimorfismos. La prevalencia de antecedentes heredofamiliares de enfermedad tiroidea fue dos veces mayor en pacientes con tales mutaciones (10). Nicoletti et al. (11) detectaron alteraciones en el gen de rTSH en un 29% de los pacientes, y en un cohorte de 38 niños y adolescentes se encontraron 11 mutaciones en este gen.
Se han identificado elevaciones leves en la TSH (4-11 mUI/L) en el periodo neonatal, las cuales normalmente no evolucionan a hipotiroidismo. La mayoría de las mismas son consecuencia de anomalías congénitas. De hecho, la mitad de los casos en series de pacientes presenta hemiagenesia, hipoplasia de un lóbulo o bocio (5).
Entre las causas adquiridas se encuentra el exceso de yodo, el cual puede causar un fenómeno denominado Wolff Chaikoff agudo, que se caracteriza por una disminución transitoria de la síntesis de hormona tiroidea, la cual protege de la producción excesiva de la misma. Los adultos normalmente pueden resolver dicho fenómeno; sin embargo, un tiroides inmaduro como el de un niño no puede escapar del mismo. Por ende, es más probable que se presente hipotiroidismo. En un estudio de población pediátrica con ingesta excesiva crónica de yodo se determinó que un 7,4% presentaban HS y menos de 1% presentaban hipotiroidismo (8).
Otra causa adquirida es la obesidad. En un metanálisis de 12 estudios se encontró una asociación positiva entre el peso y los niveles de TSH. En las cohortes analizadas un 7-23% de los niños obesos presentaron TSH moderadamente elevada con T4 normal, comparado con un 0,3-2% en niños no obesos. Varios estudios longitudinales han examinado el efecto de la pérdida de peso en la TSH. En un estudio de 246 niños obesos con niveles elevados de TSH, se documentó que los 49 niños que perdieron peso presentaron una disminución significativa de TSH lo cual no ocurrió en los demás niños. Dicho hallazgo se ha presentado en otras cohortes. Estos estudios concluyeron que la hipertirotropinemia es causada por el aumento de peso (12).
Como fue mencionado, el HS se ha asociado a causas extra tiroideas como la FQ. Estudios en cerdos con alteraciones compatibles con FQ (CFTR -/-) demostraron alteraciones en el transporte iónico en el epitelio tiroideo, y sugieren una relación entre tal patología y el hipotiroidismo. En poblaciones de humanos se detectó HS en un 11,6% de los pacientes con FQ (15,4% en adultos y 10% en niños). Además, no se encontró correlación con la función pulmonar o la malnutrición (13). En cuanto a otras enfermedades extratiroideas, se ha sugerido asociación en pacientes jóvenes con DM1 y el HS, con una prevalencia elevada de 7,2% (14).
En Italia por primera vez se estudió la relación entre atopia e hipotiroidismo. En un grupo de pacientes pediátricos italianos atópicos con valores elevados de proteína C reactiva (PCR), se obtuvo una prevalencia dos veces mayor (15,38%), comparado con el grupo control y un riesgo significativamente mayor a desarrollar HS. Se propone que los niveles crónicos de inflamación en paciente atópicos pueden promover HS (15).
En pacientes que han sobrevivido al cáncer se determinó que la enfermedad tiroidea más prevalente fue el HS (104 de 112 sobrevivientes, 92,9%). El desarrollo del mismo fue independiente del tipo de cáncer (16).
Otro grupo de pacientes en los que se ha encontrado una asociación con el HS son los pacientes con síndrome nefrótico resistente a esteroides. Un 30% de los niños con dicho síndrome presenta HS. Las hormonas tiroideas son transportadas unidas a proteínas, principalmente por la globulina fijadora de tiroxina (TBG), prealbúmina y albúmina. En el síndrome nefrótico existe una secreción urinaria aumentada de las mismas. Esto genera aumentos en los niveles de TSH (17). En pacientes con proteinuria es más frecuente el HS que el hipotiroidismo establecido por dos razones: en primer lugar, al ser la TSH una proteína de bajo peso molecular, puede perderse en estos niños; y, en segundo lugar, los corticoesteroides utilizados en los niños pueden disminuir la secreción de TSH (17).
Historia natural del hipotiroidismo subclínico:
El HS, a lo largo del tiempo, puede seguir tres rumbos diferente: progresar hacia hipotiroidismo establecido, mantenerse constante, o bien, puede ocurrir normalización de la TSH. A pesar de las limitaciones de los estudios, se ha permitido obtener una aproximación sobre qué factores, y de qué manera, inciden en el curso del HS en niños (Tabla 2).
En términos generales, las tasas de progresión en niños y adolescentes son menores que en el caso de los adultos (18), pues el HS en niños suele ser un proceso benigno y autolimitado (19). Los estudios pediátricos al respecto han demostrado un rango de desarrollo de hipotiroidismo establecido entre 0 y 28,8%, encontrándose esta última tasa en únicamente un estudio con 8 pacientes (20). Por el contrario, la gran mayoría de los casos revierten al eutiroidismo, o se mantienen constantes.
Entre los factores que se han vinculado a mayor riesgo de progresión hacia hipotiroidismo establecido, se encuentran: presencia inicial de bocio, anticuerpos anti-Tg elevados, coexistencia de enfermedad celíaca, incremento progresivo en los títulos de anticuerpos anti-TPO, y los niveles de TSH iniciales (21), siendo los niveles de TSH basales probablemente los predictores más importantes. Se ha determinado también, que los niveles de TSH >7,5 mUI/L y el género femenino son factores predictivos para mantener niveles elevados de TSH, no así la edad (22).
Otro factor de gran importancia es la etiología, pues hay mayor riesgo de progresión en el caso de tiroiditis de Hashimoto (TH) que en formas idiopáticas (18). Además, la presencia de síndrome de Turner y síndrome de Down confieren mayor riesgo (18).
Leonardi et al. (23) reportaron alta persistencia de HS en niños con falso positivo en tamizaje neonatal, aún si ninguno desarrolló hipotiroidismo establecido. La hipertirotropinemia transitoria al nacimiento puede ser riesgo para desarrollar HS más adelante en la niñez.
Hipotiroidismo subclínico idiopático:
En el estudio retrospectivo de Lazar et al. (22), se analizó una muestra de 3632 individuos con HS idiopático. Durante el periodo de seguimiento, los niveles de TSH tendieron a normalizar de manera proporcional al grado de elevación inicial; en pacientes con TSH entre 5,5 y 10 mUI/L, hubo mayores tasas de normalización de la función tiroidea, y menor desarrollo de hipotiroidismo establecido, con respecto al grupo con TSH por encima de 10 mIU/L (22). En el estudio multicéntrico prospectivo de Wasniewska et al. (24), se dio seguimiento a 92 niños italianos con HS idiopático durante 2 años. De éstos, el 41,3% normalizaron los niveles de TSH, 58,7% se mantuvieron con HS, de los cuales 12% del total incrementaron a >10 mIU/L. La evolución favorable se vio más en pacientes puberales que en prepuberales, y el resultado no varió según el sexo. En un estudio prospectivo de 5 años de duración, con 127 niñas con HS leve (TSH entre 5 y 10 mIU/L), se confirmó que el HS idiopático pediátrico se caracteriza por un pronóstico favorable a largo plazo. La mayoría de las pacientes con este diagnóstico (61,9%) normalizó los niveles de TSH, y solo una minoría (11,9%) se transformó en hipotiroidismo establecido. Por el contrario, sólo una pequeña parte (10,6%) de las pacientes con HS relacionado con TH normalizó espontáneamente al final del seguimiento, mientras que la mayoría se mantuvo constante o desarrolló hipotiroidismo establecido (25).
Hipotiroidismo subclínico relacionado con tiroiditis de Hashimoto:
La evolución del HS de etiología autoinmunitaria se caracteriza por un mayor riesgo de progresión a hipotiroidismo establecido (26).
En niños, la presentación más frecuente de la TH es el eutiroidismo, seguido por el HS y luego el hipotiroidismo establecido. La edad del paciente influye en tal presentación, con mayor riesgo de disfunción tiroidea en niños más jóvenes (18).
Existe una tendencia hacia el deterioro progresivo en los niños con TH, ya sea si se presentan con HS o con eutiroidismo. En un estudio prospectivo, se dio seguimiento a 234 niños con TH durante 5 años. Al finalizar este periodo, ambos grupos presentaron riesgo de desarrollo de hipotiroidismo establecido, con 12,3% de los eutiroideos, y 31,2% de los hipotiroideos subclínicos (27). Sin embargo, los resultados favorables continúan siendo la mayoría aún en contexto de enfermedad autoinmune (27).
En el estudio de Gopalakrishnan et al. (28), de 32 niños y adolescentes con tiroiditis autoinmune y bocio, luego de un mínimo de 2 años de seguimiento, 21,9% presentaron normalización de TSH, 65,6% se mantuvieron estables, y 12,5% desarrollaron hipotiroidismo establecido.
En el estudio retrospectivo de Radetti et al. (29), de 55 niños italianos con TH, 29,1% resultaron eutiroideos, y los restantes se mantuvieron con HS. Sin embargo, en quienes hubo incremento en la TSH más de 2 veces sobre el límite superior normal, se inició tratamiento con levotiroxina y los pacientes fueron excluidos del estudio, por lo cual no se conoce con certeza cuántos niños desarrollarían hipotiroidismo establecido. Se identificó que los siguientes factores pueden ser predictivos de desarrollo de hipotiroidismo: niveles elevados de anticuerpos anti-Tg al momento de presentación, incremento progresivo en los niveles de anticuerpos anti-TPO, así como los niveles de TSH.
Moore et al. (30) estudiaron 18 pacientes estadounidenses con TH y TSH elevada, de los cuales 11 nunca fueron tratados y 7 fueron seguidos por al menos 1 año luego de descontinuar el tratamiento. Durante este periodo de observación, la TSH se normalizó en 7 individuos, y sólo 1 desarrolló hipotiroidismo establecido. “Falsos positivos” en tamizaje neonatal e HS:
Leonardi D (23) estudió un grupo de pacientes con “falsos positivos” para hipotiroidismo congénito en el tamizaje neonatal, con T4L normal y TSH normal o ligeramente elevada. Cuando se realizó una nueva medición a los 2-3 años, 28 presentaron HS. Se dio seguimiento hasta los 9,5 años de edad. En total, la mitad revirtió al eutiroidismo al final de este periodo, mientras que el resto se mantuvo en HS, y ninguno desarrolló hipotiroidismo establecido. Se detectó en estos pacientes la presencia de hemiagenesia, hipoplasia de un lóbulo, y bocio en la mitad de estos niños, y se detectaron mutaciones en 2 individuos (de TPO y del rTSH). Se concluyó que una hipertirotropinemia leve en el tamizaje neonatal puede ser sugestivo de anomalías congénitas anatómicas o funcionales de la glándula tiroidea. Sin embargo, se debe aún confirmar estos datos y resolver la significancia clínica, pues ninguno desarrolló hipotiroidismo establecido.
Síndrome de Turner:
Esta patología se asocia a un mayor riesgo de enfermedad tiroidea autoinmune (siendo ésta la enfermedad autoinmune más frecuente), así como de enfermedad celíaca, DM1, vitiligo y artritis idiopática juvenil (18). La evolución del HS se caracteriza por un mayor riesgo de deterioro significativo a lo largo del tiempo. Esto fue demostrado en un estudio, en el que ninguna de las niñas con Turner e HS relacionado a TH logró revertir al eutiroidismo, y la mayoría progresó a hipotiroidismo establecido (25).
Síndrome de Down:
Presenta riesgo aumentado de enfermedad tiroidea autoinmune, probablemente por disregulación del sistema inmunitario con alteración en la función inhibitoria (18). El HS, sin embargo, no necesariamente es secundario a TH en estos individuos, y puede también ser el resultado de alteraciones congénitas en la regulación de la función tiroidea. En el estudio de Wasniewsk er al, se demostró que casi la totalidad de los individuos con HS se mantuvieron así, y sólo una minoría revirtió o progresó (25).
Efectos a largo plazo del hipotiroidismo subclínico en niños:
A pesar de que, por definición, el HS no asocia datos clínicos francos de déficit de hormona tiroidea, se ha reportado la presencia de síntomas sutiles, así como se ha indagado sobre la posibilidad de alteraciones bioquímicas y efectos a largo plazo (5). En adultos se ha encontrado mayor incidencia de síntomas depresivos, disminución de la calidad de vida, menor funcionalidad cognitiva y memoria, así como fatiga, aumento de peso, intolerancia al frío y constipación de manera variable (4). También se ha demostrado la asociación de HS con niveles de TSH superiores a 10 mIU/L con riesgo de eventos coronarios, mortalidad cardiovascular (31), e insuficiencia cardiaca congestiva (32). Existe aumento en el riesgo de evento cerebrovascular fatal en pacientes entre 18 y 65 años, con TSH por encima de 7 mIU/L (33). Además, se ha documentado mayores niveles de colesterol total y LDL (4). En la población pediátrica, sin embargo, se han realizado pocos estudios sobre los efectos a largo plazo del HS no tratado, principalmente sobre los efectos en el crecimiento lineal, elo desarrollo neurocognitivo, y los parámetros metabólicos de riesgo cardiovascular (26).
Crecimiento y metabolismo óseos.
Las hormonas tiroideas tienen efectos importantes sobre el desarrollo óseo y el crecimiento lineal, actuando como factores de transcripción a nivel nuclear que estimulan directamente la función del condrocito y el osteoblasto (34). Además, de manera indirecta, influyen en la actividad del eje hormona de crecimiento-factor de crecimiento similar a la insulina 1 (26). Su deficiencia establecida causa retraso en el crecimiento, y baja estatura, con maduración ósea alterada por osificación endocondral defectuosa (34).
Sin embargo, de manera consistente no se ha encontrado evidencia relevante de que haya afección en la velocidad de crecimiento ni en la talla en niños y adolescentes con HS, tanto de etiología idiopática (24) (26) (35) como autoinmune (26) (29); también se ha demostrado que la maduración ósea es normal en pacientes con HS idiopático (26) (35). No se ha encontrado alteraciones en la densidad mineral ósea (36).
Efectos neurocognitivos
Las hormonas tiroideas son factores esenciales para las distintas etapas del desarrollo cerebral, lo cual se evidencia en pacientes con hipotiroidismo congénito no tratado, quienes cursan con retraso en el desarrollo psicomotor severo y otras alteraciones neurológicas (37). Aunque aún no se conocen con detalle los mecanismos de acción específicos, están relacionados con la diferenciación celular, la migración y la sinaptogénesis; en modelos animales con deprivación de hormonas tiroideas temprano en el desarrollo, se ha constatado compromiso de la densidad de somas neuronales, conexiones dendríticas y axónicas y células gliales (37).
En cuanto a los efectos propios del HS, en un estudio realizado con 187 niños (ninguno de los cuales presentó hipotiroidismo establecido), se midieron los niveles de TSH y T4L, y se dividió el grupo en terciles, con niveles de TSH entre 3,78-8,6 para el tercer tercil, el cual es el más elevado. Se encontró que los pacientes en tal tercil presentaron una leve disminución en la comprensión verbal y memoria inmediata; las diferencias fueron ligeras, pero estadísticamente significativas (38). Además, en un estudio con 17 pacientes con HS, se documentó una disminución significativa en el rendimiento en pruebas sensibles en detectar alteraciones en la atención, sin alteraciones en otras áreas (39), lo cual también se documentó en otro estudio con 11 pacientes. Sin embargo, los sujetos no presentaban historia de hiperactividad ni distracción, ni hubo mejoría a corto plazo al tratar con reemplazo hormonal (40). Adicionalmente, en otros estudios se ha observado rendimiento normal en distintas pruebas cognitivas, incluyendo las de atención, e inclusive hubo mejor desempeño en algunas áreas (41), así como se encontró coeficiente intelectual normal (35). En síntesis, la función cognitiva es normal en niños y adolescentes con HS; a pesar de que el área de atención se ha visto afectada, el hecho de que no mejore con el reemplazo hormonal sugiere que no hay una relación clara de causalidad.
Efectos cardiovasculares:
Generalidades: Las hormonas tiroideas actúan aumentando la función diastólica en el miocardio, así como la contractilidad y disminuyen las resistencias vasculares periféricas (42). Aumentan la lipólisis, la β oxidación, la gluconeogénesis hepática, y disminuyen la sensibilidad a la insulina hepática. En el miocito, aumentan el metabolismo oxidativo y la utilización de glucosa (26). Además, se ha encontrado que la TSH estimula la 3-hidroxi-3-metilglutaril-coenzima A (HMG-CoA) reductasa, enzima limitante en la síntesis de colesterol (43), por lo cual estados de hipertirotropinemia podrían aumentar este proceso.
A diferencia de los adultos, en niños la asociación con eventos cardiovasculares adversos no ha sido establecida, pero se cuenta con datos poco claros sobre el aumento en factores de riesgo de enfermedad aterosclerótica (26).
Dislipidemia: En términos generales son el dato que se ha asociado de manera más consistente al HS. Se ha documentado en múltiples estudios una disminución en el colesterol HDL en pacientes con HS (44) (45) (46); inclusive, se ha encontrado relación con los niveles de TSH, pues en un estudio transversal hubo disminución en HDL para pacientes con TSH >10 mIU/L, mientras que no hubo anormalidades con niveles inferiores (47). Se ha observado también que conforme aumenta la TSH, aumentan los triglicéridos (48) (49), el colesterol total y el colesterol LDL (49). Al comparar propiamente pacientes eutiroideos con sujetos con HS, se ha documentado que estos últimos presentan niveles de CT, LDL (43) y TG (46) aumentados. En algunos ensayos, sin embargo, no se han constatado diferencias en los niveles de triglicéridos y CT (44) (45).
Presión arterial:
Se ha documentado un aumento lineal en la presión arterial sistólica y diastólica, en niños y adolescentes conforme aumentan los niveles de TSH, aún dentro del rango de referencia (50), con cifras tensionales más elevadas en sujetos con HS con respecto a eutiroideos (49) (51). Estos datos sugieren que el HS se asocia con un aumento en el riesgo de hipertensión arterial (50). Sin embargo, otros autores no han logrado demostrar tal relación (44) (46) (52).
Metabolismo de la glucosa:
Se han identificado aumentos en las concentraciones de insulina y del índice HOMA conforme aumenta la TSH, aun en el rango de normalidad (48), pero sin diferencia en glicemia en ayunas (46). En otros estudios, no se han presentado tales alteraciones (44) (49) (53).
Otros marcadores de riesgo: homocisteína, inflamación, disfunción endotelial
Los factores de riesgo cardiovasculares no tradicionales también han sido sujeto de algunos estudios. En cuanto a la homocisteína, en uno de ellos se encontró mayores niveles de homocisteína en individuos con HS, con respecto a controles eutiroideos (44), mientras que en otro no hubo diferencia (54).
En cuanto a marcadores inflamatorios, no se encontró relación entre el HS y niveles elevados de proteína C reactiva de alta sensibilidad ni fibrinógeno (44). En cuanto al grosor íntima-media carotídeo como marcador de aterosclerosis subclínica, en un estudio se encontró un aumento significativo del mismo en pacientes con HS (43), mas otro autor no documentó diferencias (46).
Obesidad:
Es común encontrar alteraciones en la función tiroidea en niños obesos, con prevalencias de HS que pueden llegar hasta 10-23% (55). La severidad del HS está condicionada por el grado de sobrepeso, y no cambia entre sexos o edad. Los mecanismos fisiopatológicos no están claros, aunque se ha propuesto el rol de la leptina, la cual está aumentada en pacientes obesos, y algunos reportes sugieren que afecta la regulación hipotalámica de la producción de TSH (18). Debido a que el HS normalmente revierte con la pérdida de peso, probablemente es una complicación reversible del sobrepeso y no una causa. Por estos motivos, se debería evitar cualquier tratamiento y el monitoreo no debe ser estricto. También se debe considerar que los niveles de T3L frecuentemente están elevados en niños obesos, probablemente por un proceso adaptativo secundario a la ganancia de peso (18). Sin embargo, existe la posibilidad de que la combinación de ambos condicione a un mayor riesgo de síndrome metabólico (56), pues tanto la circunferencia abdominal, como la relación cintura-altura, se encuentran significativamente elevados en los niños obesos con HS, en comparación con obesos eutiroideos (44) (49).
Efectos de terapia de reemplazo con levotiroxina:
Los datos con respecto a los beneficios de tratar el HS son pocos claros. Actualmente los problemas más importantes son la ausencia de un valor bien definido de TSH que garantice la protección de los tejidos al hipotiroidismo y las limitaciones en los estudios realizados (3) (57). Uno de los campos más estudiados es el beneficio en parámetros antropométricos; sin embargo, los resultados son diversos. Cetinkaya et al. (58) trataron con 2 µg/kg de levotiroxina a 39 niños con HS y baja talla; se observó un aumento significativo en su altura y ninguno de los mismos progresó a hipotiroidismo. En otro estudio realizado con 25 niños con hiperplasia suprarrenal congénita y DM1 pre puberales y puberales tratados con 2-4 µg/kg de levotiroxina, se encontró un aumento en la velocidad de crecimiento, comparado con un control de 25 niños con DM1 (59). Eyal et al. (60) evaluaron los efectos en el crecimiento, donde se compararon 8 pacientes con HS y anemia de Fanconi, asignándolos aleatoriamente, ya sea a tratamiento con LT4 con 3 µg/kg/d o placebo. Se documentó una mejoría en la velocidad de crecimiento, y un 12.5% de sobretratamiento. En un estudio no aleatorizado con 69 niños con HS tratados con levotiroxina, no se demostró que mejorara el IMC o la estatura en comparación con niños con HS no tratados (57) (61). De Luca et al (62) analizaron a 36 niños, seguidos por 3-9 años, y no encontraron mejoría en cuanto a crecimiento, maduración ósea, IMC o función cognitiva en niños tratados con LT4.
En cuanto a los efectos neurocognitivos, un estudio no aleatorizado con solamente 11 niños con HS no demostró beneficio del tratamiento con levotiroxina tras 6-8 semanas de tratamiento, el cual es criticado ampliamente por su duración (57).
En cuanto a los beneficios cardiovasculares, los resultados son poco concluyentes. En niños con HS se ha documentado niveles altos de dimetilarginina asimétrica (ADMA), indicador de disfunción endotelial. El tratamiento con LT4 mejoró tanto adiposidad visceral, como niveles de ADMA en niños con HS (63). Los estudios en cuanto a morbilidad cardiovascular son variables y no son en población pediátrica. En estudios con población general, se concluyó que no existe beneficio en cuanto a morbilidad cardiovascular; sin embargo, existe mejoría en la función ventricular izquierda y los parámetros lipídicos. En un estudio aleatorizado de 40 mujeres con HS, 23 recibieron terapia LT4 y las demás permanecieron sin tratamiento. Luego de 6 meses, no se encontraron cambios significativos en los parámetros antropométricos ni en el perfil de lípidos (3).
En cuanto a los efectos del tratamiento sobre el tamaño tiroideo, en un estudio con 42 niños suecos con HS y TH, tras 2 años de tratamiento se documentó disminución en el volumen tiroideo (64). En un estudio retrospectivo en un grupo de 16 niños estadounidenses con TH tratados con LT4, en un 75% no se observó cambios en el volumen tiroideo (65).
En la población de niños obesos, sólo existe un único estudio, que consistió en una cohorte prospectiva, en la cual 15 niños recibieron 1-2 µg/kg de tiroxina y cambios en el estilo de vida. En comparación con 26 niños tratados sólo con cambios en el estilo de vida. Todos los niños presentaron mejoría en sus niveles de TSH; sin embargo, no se presentaron cambios significativos en peso, IMC, perfil de lípidos o crecimiento (12).
Progresión a hipotiroidismo:
La prevención de la progresión a hipotiroidismo con el tratamiento con LT4 no se ha logrado demostrar (59). En un estudio por Wasniewska ert al en 2012 (66), se trató con LT4 vs placebo durante 2 años a niños con HS leve e idiopático. Durante el mismo los niños tratados presentaron niveles menores de TSH, sin embargo tres meses posteriores a finalizar el estudio no existió diferencia significativa en los pacientes que desarrollaron niveles de TSH mayores a 10 mUI/L; concluyendo así que el tratamiento con LT4 no modifica la historia natural del HS (66).
Manejo del hipotiroidismo subclínico.
La decisión de tratar el HS en niños es complicada debido a que la calidad de la evidencia no es suficiente para ofrecer recomendaciones fuertes. La mayoría de consecuencias de la hipertirotropinemia se han extrapolado de adultos, como lo son el incremento en las enfermedades cardiovasculares, la depresión, la dislipidemia y el aumento en las concentraciones de prolactina. Sin embargo, de los adultos se ha aprendido que el sobretratamiento puede producir reducción de la densidad ósea y trastornos del ritmo (65).
Al no haber datos claros del beneficio de tratar a niños con HS, el manejo expectante con controles periódicos es la norma actualmente, teniendo claro que la progresión a hipotiroidismo puede ocurrir (1). La Asociación Europea de Tiroides recomienda dar seguimiento con mediciones hormonales cada 12 meses en el caso de HS idiopático, y cada 6 meses si existe etiología autoinmune (57).
Se han propuesto algoritmos para el manejo de dichos pacientes. En caso de que se detecte un niño con TSH entre 5-10 mIU/L, el primer paso es repetir el examen en otro laboratorio, 1-3 meses después, pues puede tratarse de una hipertirotropinemia transitoria. Posteriormente se deben valorar los factores de riesgo de progresión. Se debe considerar el inicio de tratamiento con LT4 si el niño presenta bocio, anticuerpos anti-TPO, niveles de TSH con aumentos progresivos, historia de enfermedad tiroidea en la familia, otras enfermedades autoinmunes como TH o enfermedad celiaca; síndrome de Turner, síndrome de Down o radiación previa de cuello (1) (3) (57). Además de tales grupos, la ATA (American Thyroid Association) recomienda el tratamiento con TSH mayor a 10 mIU/L o pacientes sintomáticos (61) (65).
La decisión de tratar o no se debe discutir claramente con los padres para evaluar el riesgo-beneficio individualizado. En la actualidad existe muy poca evidencia para recomendar el tratamiento con levotiroxina (57). En caso que se decida iniciar el reemplazo, los controles periódicos son muy importantes para evitar el sobretratamiento (61) (65).
Conclusiones:
El HS en niños aun es un tema que require ser estudiado, pues la evidencia actual es en muchos casos contradictoria, y basada en ensayos con muestras pequeñas y poblaciones heterogéneas que les brindan calidad menor a la deseada. Sin embargo, se conoce que en muchos casos es una condición autolimitada y más benigna que en adultos, tanto en cuanto a riesgo de progresión como en efectos adversos. De particular importancia en la población pediátrica, el HS no se ha asociado con menor estatura en niños, ni deterioro franco neurocognitivo. Tampoco se ha relacionado con eventos adversos cardiovasculares, a diferencia en adultos, aunque es probable que confiera mayor riesgo de dislipidemias e hipertensión arterial.
El objetivo fundamental de comprender esta patología en su totalidad debe ser el beneficio del paciente; el conocimiento de sus consecuencias debería orientar a cómo mitigarlas, y el debate de cuándo tratar debe estar regido por los beneficios que se puedan obtener en el paciente específico, sin caer en sobretratamiento. Por tal razón, aunque no existe actualmente un consenso de cuándo tratar el HS en niños y adolescentes, la decisión es individualizada, tomando en cuenta los factores que se han asociado con riesgo de progresión, como son la TH subyacente, niveles de TSH por encima de 10 mIU/L, enfermedad celíaca, síndrome de Down y síndrome de Turner.
Asimismo, el tratamiento con reemplazo hormonal no ha demostrado beneficio en parámetros antropométricos, perfil lipídico, efectos neurocognitivos, ni en el riesgo de progresión, por lo cual se debe evitar el tratamiento si no hay razones de peso para iniciarlo.
Conflictos de interés RB y FC son miembros de la Asociaciónn Nacional para Estudio de la Diabetes, Endocrinología y Metabolismo. | |||||||||
| References | |||||||||
| |||||||||